Newsletter (2020年6月) │ 知財
優先権制度はパリ条約4条に規定されている様に、同盟国の国民が他の同盟国へ出願する際の言語的及び手続的の不平等を解消するための制度であり、中国において特許法第29条と特許法実施細則第32条により規定されている。しかし、優先権の認定に際し同一主題の発明が最初の先行出願に記載されているか否かの判断はまだ明確されておらず、業界内でも議論されてきた(例えば、ZL97197460.8の無効審判事例、ZL201510398190.1の無効審判事例を参考)。
今般、ZL201210399309.3、発明の名称「糖尿病を治療するためのジペプチジルペプチダーゼ阻害剤」の無効審判事例では、医薬分野出願の特許における優先権の認定に関する問題が焦点になり、合議体により審査の方針が示された。以下では、該事例に対して簡単に紹介し、同一主題の発明の判断要件について説明する。
一.本件特許について
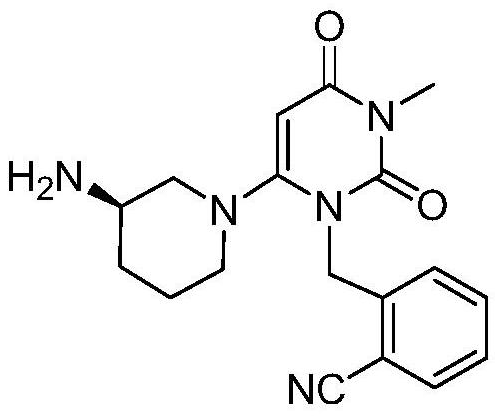
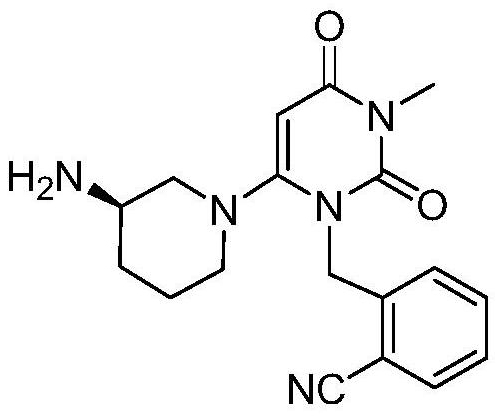
本件特許の出願日が2006年09月13日であり、US60/717558(優先日:2005年09月14日)とUS60/747273(優先日:2006年05月15日)の2件の外国優先権を主張していた。
本件特許の請求項1:
以下の構造式を有し、経口投与で1日あたりの投与量が5㎎から250㎎である、II型糖尿病を治療する医薬組成物を製造するための化合物Iの応用。
(ここで、化合物Iは、医薬上許容され得る塩又は遊離の塩基として存在する。)
二.請求人の主な請求理由と主な証拠
請求項1~17は証拠4に対して優先権の主張が成立できず、新規性を有しないため、特許法第22条第2項の規定を満たしていない。
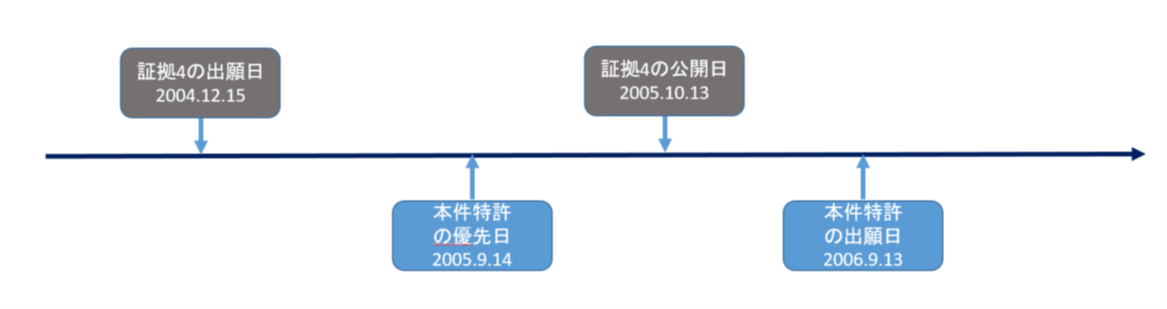
証拠4は本件特許の特許権者が出願した先行出願WO2005/095381A1で、出願日が2004年12月15日であり、公開日が2005年10月13日である。証拠4と本件特許との時間関係は下図の通りである。
証拠4においてDPP-4阻害剤としての化合物I、化合物Iの遊離塩基、薬学上許容され得る各種の塩、及び化合物Iを含む組成物及びそれらの製造例が開示され、糖尿病の治療に使用でき、経口投与を含む投与方法に適することも開示されている。
請求人の主張は以下の通りである。
経口投与や1日あたりの投与量という技術特徴は共に医薬品の使用方法に該当し、スイス・タイプ・クレームである請求項1に対して実質的な影響を与えず、限定的作用を有しない。証拠4に本件特許と同じ主題の発明が公開されているため、本件特許が主張している優先権の先行出願は最初の出願ではなく、優先権の主張が成立できない。証拠4に化合物1の遊離塩基、各種の薬用可能な塩が開示され、しかもその効能と製剤実例も開示されている。従って本件特許の請求項1は証拠4に対して新規性を有しない。
三.特許権者の反論
(1)先行出願と後の出願の主題が同じか否かの判断は先行出願に対して後の出願が新規性を有するか否かの判断とは異なる。後の出願の請求項に限定されている技術方案と、先行出願に記載されている技術方案とを比較し、両者が同じか否かを確定してから、両者の主題が同じであるかを確定すべきである。
(2)請求項1における技術特徴「1日あたりの投与量が5mg~250mgである」は請求項の必須部分である。証拠4には請求項1に限定されている化合物IがII型糖尿病を治療する医薬品を製造するための用途が開示されていない。また、請求項1の医薬組成物は1日あたりの投与量が5mg~250mgである化合物Iを経口投与でII型糖尿病の治療に使用し、化合物Iが薬学上許容できる塩又は遊離塩基の形式で存在するという内容も開示されていない。証拠4に請求項1-17のいずれの技術方案と同じ技術方案が開示されていないため、本件特許が優先権を主張できる。
四.争論点
本件特許が優先権を主張できるか、つまり、証拠4には本件特許の請求項の発明と同じ主題の発明が記載されているか否か。
五.合議体の認定
優先日よりも前の先行出願に本件特許の請求項の発明と同じ主題の発明が記載されているかを判断する際、両者が属する技術分野、解決する技術問題、採用された技術方案及び予期できる技術効果が同じか否かを全体的に考査すべきであるとして、具体的に、合議体は以下の通り認定した。
(1)技術分野について
本件特許明細書の記載によると、本件特許は糖尿病治療の技術分野に属し、具体的にDPP-4阻害剤を使用して糖尿病を治療する技術分野に属する。
証拠4の発明名称はジペプチジルペプチダーゼ阻害剤であり、明細書の記載によると、新しいDPP-4阻害剤を使用して、糖尿病、特にII型糖尿病を治療する技術分野に属すると記載されている。
よって、両者の技術分野は同じである、と判断された。
(2)技術問題
本件特許の解決する技術問題は、糖尿病の治療に適したDPP-4阻害剤の化合物及びその医薬組成物を製造することである。
証拠4の解決する技術問題は、糖尿病を治療するための新たなDPP-4阻害剤を提供することである。
よって、両者の技術問題は同じである、と判断された。
(3)技術方案
両技術方案が同じか否かを判断する際、記載内容が形式的に完全に一致しているかに拘らず、両者の実質的な内容を考慮すべきである。しかし、請求項に限定的作用を有しない内容を技術方案の比較範疇に入れてはならない。このような限定は両者の主題に対して実質的な変化を起こさないからである。製薬用途クレームに含まれる用法用量は医師が治療中に医薬品を如何に使用するかに関する方法であり、医薬品の製造プロセスと関係がないため、製薬用途クレームの保護範囲に実質的な影響を与えず、請求項及びその保護範囲を理解する際には考慮されるべきではない。
本件特許の請求項1は化合物Iの1日あたりの投与量が5mg~250mgであることを限定している。しかし、該特徴は投与方法に該当し、請求項の保護範囲に対して影響を与えないため、本件特許の請求項1は、以下の通りに理解されるべきである。
請求項1:
以下の構造を有し、経口投与でII型糖尿病を治療する医薬組成物を製造するための化合物Iの応用。
(ここで、化合物Iは、医薬上許容され得る塩又は遊離の塩基として存在する。)
なお、証拠4は上記技術問題を解決するために、本件特許の化合物I又は該化合物Iを含む医薬組成物をDPP-4阻害剤として糖尿病を治療する技術方案を提供した。更に、証拠4の明細書に技術方案に対して詳しく説明を行った。具体的に、化合物Iを含む該医薬組成物は経口投与を含む投与経路に適している。そして証拠4の化合物Iは遊離塩基又は酸付加塩の形式であってもよい。明細書の実施例では、化合物Iを含む30の具体的DPP-4阻害剤の製造例が開示されている。証拠4の明細書には、更に、各測定方法により、各化合物のプロテアーゼ阻害効果を測定し、選択性DPP-4阻害作用を確認できたと記載されている。
単純に文言の記載から見れば、証拠4に本件特許の請求項1の表現と完全に同じ技術方案は記載されていない。しかし、証拠4に記載されている技術情報からみれば、証拠4は全体的に本件特許の化合物Iはその塩または遊離塩基を活性成分として経口投与の医薬品を製造することができ、該医薬品はII型糖尿病を含むDPP-4関連の疾病に使用できるという内容を開示している。
従って、両者の技術方案が同じである、と判断された。
(4)技術効果
両者が達成できる技術効果が同じであるか否かを判断する際に、先申請原則に基づき、優先日より早い先行出願には当業者により確認できる効果が達成され且つ記載されているかを審査する。仮に優先日より早い先行出願により提供された実験に基づいて、当業者が関連技術問題を解決でき、予期する技術効果を達成でき、後の出願の実験は先行出願の実験に対して単に完備と補充しただけであれば、両者が同じ技術効果を実現できると判断できる。
本件特許は、化合物Iを含む医薬組成物の経口投与により血漿DPP-4活性を効果的に阻害し、II型糖尿病の血糖値、グリコシル化ヘモグロビン、空腹時フルクトサミンのレベルを効果的に低下させるという技術効果を達成できた(実施例6〜8を参照)。
証拠4に記載されている技術効果に関しては、II型糖尿病を含む疾病を治療すると記載され、実施例ではDPP-4測定法を記載し、化合物が選択的なDPP-4阻害活性を示し、DPP-4の見かけの阻害定数(Ki)が約10-9Mから約10-5Mの範囲にあることが記載されている。
証拠4はDPP-4阻害活性があることを確認しているが、本件特許の明細書ではDPP-4阻害活性以外に、II型糖尿病患者に対して臨床試験を行い、血糖降下作用を確認し、更にマウスに対して、薬物併用による血糖降下試験を実施した。しかし、当業者は、常識と証拠4に基づき、DPP-4阻害活性を有することが、DPP-4によるGLP-1の切断を阻害することによってインスリン分泌とグルカゴン分泌を刺激し血糖値を下げることができ、II型糖尿病の治療に使用されることを確認できる。従って、証拠4を全体として分析すると、当業者は、本件特許の化合物Iを含む医薬組成物がII型糖尿病の治療に適していることを確認することができる。本件特許の明細書に記載された糖尿病患者とマウスに対して行われた血糖の研究は、証拠4に既に検証されたDPP-4の阻害活性に対して単に補充しただけであり、新しい技術効果が生み出していない。
従って、証拠4に開示されている技術方案は、本件特許の請求項1と同じ技術効果を有する。
上述の通り、証拠4に既に本件特許の請求項1と同じ主題の発明が開示されているため、US60/717558とUS60/747273とが最初の出願ではない。本件特許の請求項1は該二つの優先権を主張できない。
本件特許は証拠4に対して新規性がないとして、全部無効にされた。
六.弊所のコメント:
(1)優先権の成立条件について
特許法第29条、特許法実施細則第32条では、優先権について規定しており、優先権基礎としての先行出願と後の出願とは同じ主題を有し、しかも先行出願は最初の出願である必要がある。同じ主題は四要素が同じであることを意味し、1)先行出願と後の出願が属する技術分野、2)解決する技術問題、3)採用された技術方案、及び4)技術効果が同じであることを意味している。技術方案が同じであるかを判断する際には、先行出願の請求の範囲に記載されている内容に限らず、出願書類に開示されたすべての内容が考慮される。
また、最初の出願について、仮に該出願人の優先権主張の基礎である先行出願よりも早く、同じ主題が記載されている出願がされた場合、該先行出願は最初の出願ではないため、優先権の基礎とすることができない。実務の中で、最初の出願でない理由で優先権の主張が認められない事例は極稀であるため、それに関する審査の基準があまり知られていないのが実情である。今回の事例で典型的な事例として法律解釈の意味を示した。
(2)1日当たりの投与量について
技術方案が同じであるか否かを判断するには、後の出願の請求項における技術特徴は請求項に対して限定的作用がない技術特徴であれば、考慮されないということが明確にされた。本件特許において、請求項1における技術特徴「1日当たりの投与量が5mg~250mgである」は医薬品の使用方法に該当し、医薬品の組成成分や構造に対して実質的に限定作用を有する技術特徴でない。医薬分野では、用法用量、例えば投与間隔、投与量等が原則的に、医薬品に対して限定的作用を有しないと認定されており、優先権の主張の可否の判断には、技術方案の比較の対象として考慮されない。しかし、一部の特徴に対して、例えば投与対象など、ケースバイケースで具体的に分析する必要があり、限定作用を有すると判断された事例もある(弊所のニュースレター、中国におけるスイス・タイプ・クレームの現状https://se1910.com/ja/newsletters-ja/china-ip-newsletter-may-2018/をご参考ください)。
また、アログリプチンを巡る本件特許の無効審判事例を含む三つの無効審判事例の該用法用量について、以下の通り説明する。
10例の不服審判無効審判重要事例(2019年度)に選ばれたZL200680042417.8の無効審判事例では、「単一剤形に製剤される医薬組成物であって、当該単一剤形が5mgから250mgの化合物Iを含有する医薬組成物」(一部抜粋)と限定されている請求項1において、「単一剤形」に一回で一定の量の医薬品を投与するという医薬品の使用方法特徴が含まれる。しかし、該特徴と医薬組成物という主題とを組みあわせて検討すれば、該特定量の単一剤形は実質的に医薬組成物の形式に対する限定である。即ち、5mgから250mgの化合物Iを含有単一剤形は、医薬組成物の組成成分や構造に対して実質的な影響を与えるため、技術特徴として考慮された。
なお、ZL201210332271.8の無効審判事例では、「化合物Iと薬学上許容され得る担体とを有する医薬組成物であって、1日あたりの投与量が5mgから250mgである医薬組成物」(一部抜粋)と限定されている請求項1において、「1日あたりの投与量が5mgから250mg」という内容が医薬品の使用方法に該当し、医薬品の組成成分や構造に対して実質的に限定作用を有する技術特徴でないと判断された。
このように類似している表現のように見えるが、「単一剤形」という表現は複数投与剤形と区別できるため、実質的に限定的作用を有する技術特徴として認められていることを今後の実務に利用できると思われる。
(3)優先権の成立判断と新規性の判断について
優先権の成立判断にも新規性の判断にも同じ主題の発明であるかを判断するステップが含まれ、両者は類似している部分がある。先行出願を引例として見做し、後の出願が該引例に対して新規性を有するかを判断する。当該後の出願は先行出願に対して新規性を有しなければ、優先権を享受することができる。逆に、該後の出願は先行出願に対して新規性を有すれば、優先権を享受することができない。しかし、優先権の成立判断と新規性の判断とは完全に同じではない。例えば、ある技術特徴は先行出願において下位概念であるが、後の出願では上位概念に拡大した場合、後の出願は先行出願に対して新規性を有しなくても、優先権の主張が成立できない。後の出願に新しい技術内容を増やしたため、両者が同じ主題の発明ではなくなったからである。
(4)補足した実験内容の技術効果への影響について
一般的に技術方案が同じであることは四要素の判断に最も重要であり、仮に技術方案が実質的に同じであれば、技術分野や、技術問題と予期できる技術効果も同じであると言える。しかし、医薬分野では、技術効果が同じであることも四要素の判断に同じく重要なファクターである。医薬化学分野の技術効果の予見性は低いため、必須の実験データにより証明されなければならない。出願人が最初の出願を提出した後、新剤型、新効能などの研究を行い、更に臨床研究を展開することが多い。両者の技術効果が同じであるかを判断するには、後の出願が先行出願の技術効果に対して補充しただけなのか、それとも新しい技術効果が生まれたのか等を検討すべきである。
(5)抵触出願との関係について
2009年中国特許法が改正された前に、新規性を阻害する抵触出願は日本でいう拡大された先願とほぼ同等な意味を持ち、出願人自身が出願した先行出願は抵触出願に含まれなかった。2009年以後に抵触出願の対象は如何なる単位又は個人により出願された先行出願まで広げたため、2009年以降の類似事例に対しては、本無効審判事例の証拠4のような、優先日以前に出願され、出願日以降に公開された先行出願は直接に新規性を否定する証拠として審査される。
以上の通り今回の事例では特許庁の審判部の医薬分野の優先権の認定基準を把握できるようになった。典型的な事例として今後の類似の事件に対して指導的意味を示すことが期待されている。
参考: