最高裁判決(平成27年11月17日最高裁第三小法廷判決・平成26年(行ヒ)第356号)に倣って、特許権の存続期間の延長登録出願に関する審査基準が改訂され、4月中を目途に改訂審査基準の運用が開始する予定です。
以下、改訂審査基準案に関して簡単に説明します。
現行の審査基準
特許法第67条の3第1項第1号によれば、「その特許発明の実施に第67条第2項の政令で定める処分を受けることが必要であった」とは認められないときには、延長登録出願は拒絶されます(※政令で定める処分としては、以下の二つが規定されています(特許法施行令第2条)、(i) 農薬取締法の規定に基づく農薬に係る登録、(ii) 薬機法の規定に基づく医薬品、体外診断用医薬品、再生医療等製品に係る承認・認証)。
現在の審査基準では、本件処分に先立つ先行処分がある場合において、延長登録の出願に係る特許発明のうち、本件処分の対象となった医薬品類又は農薬の「発明特定事項(及び用途)に該当する事項」によって特定される範囲が、先行処分によって実施できるようになっていたときに、特許法第67条の3第1項第1号に基づく拒絶理由が通知されることになります。
最高裁の判示
しかし、上記最高裁判決は、かかる審査基準は否定されるべきものであることを判示しました(下線は弊所で付したものです)。
「先行処分と出願理由処分とを比較した結果,先行処分の対象となった医薬品の製造販売が,出願理由処分の対象となった医薬品の製造販売をも包含すると認められるときには,延長登録出願に係る特許発明の実施に出願理由処分を受けることが必要であったとは認められないこととなるというべきである。そして,このように,出願理由処分を受けることが特許発明の実施に必要であったか否かはあくまで先行処分と出願理由処分とを比較して判断すべきであり,特許発明の発明特定事項に該当する全ての事項によって判断すべきものではない。」
「出願理由処分と先行処分がされている場合において,延長登録出願に係る特許発明の種類や対象に照らして,医薬品としての実質的同一性に直接関わることとなる審査事項について両処分を比較した結果,先行処分の対象となった医薬品の製造販売が,出願理由処分の対象となった医薬品の製造販売を包含すると認められるときは,延長登録出願に係る特許発明の実施に出願理由処分を受けることが必要であったとは認められないと解するのが相当である。」
改訂審査基準案
改訂審査基準案では、上記最高裁判決の判示に倣って、次のことが説明されています。
「本件処分及び先行処分の対象となった医薬品類の製造販売の行為又は農薬の製造・輸入の行為が延長登録出願に係る特許発明の実施行為に該当する場合において、先行処分の対象となった医薬品類の製造販売又は農薬の製造・輸入が、本件処分の対象となった医薬品類の製造販売又は農薬の製造・輸入を包含しているとき」には、特許発明の実施に政令で定める処分を受けることが必要であったとは認められず、拒絶理由が生じる。
包含するか否かは、「延長登録出願に係る特許発明の種類や対象に照らして、医薬品類又は農薬としての実質的同一性に直接関わることとなる審査事項について両処分を比較」することにより判断される。
「包含」について
「先行処分の対象となった医薬品類の製造販売又は農薬の製造・輸入が、本件処分の対象となった医薬品類の製造販売又は農薬の製造・輸入と一部重複している場合も包含の一態様とする」
「実質的同一性に直接関わることとなる審査事項」について
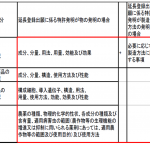
特許発明の種類や対象並びに政令で定める処分に関連して、次の例が挙げられています(下記表の赤枠内が「実質的同一性に直接関わることとなる審査事項」の例示)。
さらに、本件処分と先行処分との違いを明確にする必要がある場合には、願書の記載事項における「第67条第2項の政令で定める処分の内容」の「用途」欄に、例えば「用法、用量」を記載することができるようになります。