Par. 67 (2) PatG: Laufzeitverlängerung für zulassungspflichtige Erfindungen
In Übereinstimmung mit dem Urteil des Obersten Gerichtshofes in Japan (Urteil des dritten kleinen Senats des Obersten Gerichtshofes vom 17. November 2015 (Nr. (Gyo-Hi) 356/2014)) wurden die japanischen Prüfungsrichtlinien betreffend die Verlängerung der Patentlaufzeit geändert. Das Japanische Patentamt (JPO) führt die Prüfungen auf Basis der geänderten Prüfungsrichtlinien seit Ende April 2016 durch.
Gemäß Par. 67 (2) PatG kann die Patentlaufzeit per Antrag um einen Zeitraum von höchstens fünf Jahren verlängert werden, wenn die patentierte Erfindung für einen bestimmten Zeitraum nicht benutzt werden konnte, z.B. wenn Zulassungen oder sonstige Verfügungen[1] aufgrund der Kabinettsverordnung gemäß Par. 67(2) erforderlich sind.
Gemäß Par. 67ter(1)(i) PatG sollte der Prüfer den Antrag auf Verlängerung der Patentlaufzeit mit der Begründung zurückweisen, dass die Verfügung aufgrund der Kabinettsverordnung gemäß Par. 67 (2) für die Benutzung der patentierten Erfindung als nicht erforderlich angesehen wird.
In einem Fall, in dem bereits eine ältere Verfügung vorliegt und ein Antrag auf Verlängerung basierend auf einer weiteren Verfügung (aktuelle Verfügung) gestellt wird, ergeht gemäß den vorherigen Prüfungsrichtlinien nach Par. 67ter(1)(i) PatG eine Mitteilung von Zurückweisungsgründen, wenn der Umfang der aktuellen Verfügung bereits im Umfang der älteren Verfügung benutzbar war. Der Umfang wird durch jene Merkmale des pharmazeutischen Produkts bzw. der Agrochemikalie, welche den Merkmalen der erteilten Ansprüche entsprechen, sowie durch die Verwendung des pharmazeutischen Produkts bzw. der Agrochemikalie (auch wenn die in Frage stehende Verwendung nicht einen Teil des erteilten Schutzumfangs darstellt) definiert.
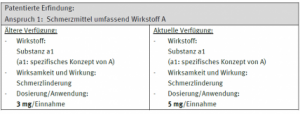
Im Folgenden ein Beispiel für einen Antrag auf Verlängerung der Patentlaufzeit eines phar-mazeutischen Produktes, der gemäß den vorherigen Prüfungsrichtlinien zurückgewiesen wird:
Da der Wirkstoff und die Verwendung (Merkmale der erteilten Ansprüche) der älteren Verfügung und der aktuellen Verfügung gleich sind, wird der Antrag auf Verlängerung der Patentlaufzeit in Bezug auf die aktuelle Verfügung zurückgewiesen, obwohl die beiden Verfügungen unterschiedliche Dosierungen/Anwendungen betreffen.
Urteil des Obersten Gerichtshofes
Im Urteil des Obersten Gerichtshofes vom 15. November 2015 hat der Gerichtshof eine ältere Verfügung und eine aktuelle Verfügung zu einem einzigen Patent verglichen und entschieden, dass der Vergleich nicht mehr für die Merkmale der erteilten Ansprüche, sondern für die „Prüfungsgegenstände unmittelbar bezogen auf die substantielle Identität“ der pharmazeutischen Produkte bzw. Agrochemikalien entsprechend der Art der patentierten Erfindung durchgeführt werden sollte.
Prüfungsrichtlinien
Dem Urteil des Obersten Gerichtshof folgend erklären die geänderten Prüfungsrichtlinien: Wenn die Herstellung und der Verkauf des pharmazeutischen Produkts bzw. die Herstellung oder Einfuhr der Agrochemikalie einer älteren Verfügung die Herstellung und den Verkauf des pharmazeutischen Produkts bzw. die Herstellung oder Einfuhr der Agrochemikalie der aktuellen Verfügung umfassen, liegt ein Zurückweisungsgrund gegen den auf der aktuellen Verfügung basierenden Antrag auf Verlängerung der Patentlaufzeit vor. Ob die Herstellung und der Verkauf des pharmazeutischen Produkts bzw. die Herstellung oder Einfuhr der Agrochemikalie einer älteren Verfügung die Herstellung und den Verkauf des pharmazeutischen Produkts bzw. die Herstellung oder Einfuhr der Agrochemikalie der aktuellen Verfügung umfassen, wird durch den Vergleich der „Prüfungsgegenstände unmittelbar bezogen auf die substantielle Identität“ des pharmazeutischen Produkts bzw. der Agrochemikalie der beiden Verfügungen bestimmt.
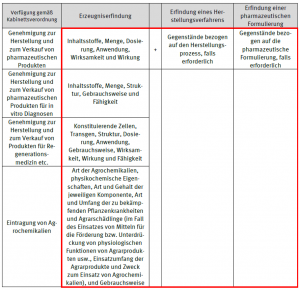
Beispiel in den Richtlinien zum “Prüfungsgegenstand unmitelbar bezogen auf die substantielle Identität”
Die geänderten Prüfungsrichtlinien enthalten sowohl die folgenden Beispiele mit bestimmten Verfügungen als auch die „Prüfungsgegenstände unmittelbar bezogen auf die substantielle Identität“ entsprechend der Art der patentierten Erfindung (siehe rote Umrahmung):
Für das oben genannte Beispiel mit unterschiedlicher Dosierung/Anwendung in der älteren und der aktuellen Verfügung (Steigerung auf 5 mg pro Einnahme) bedeutet dies, dass gemäß den geänderten Prüfungsrichtlinien ein Unterschied im Prüfungsgegenstand “Dosierung/Anwendung” vorliegt, und deshalb die Wahrscheinlichkeit, dass der Antrag auf Verlängerung zurückgewiesen wird, sehr gering ist. Gemäß den geänderten Prüfungsrichtlinien ist es auch möglich, solche in den Verfügungen vorhandenen Unterschiede in den Antragsunterlagen durch Angabe des Unterschiedes in der Dosierung/Anwendung darzulegen.
[1] Eine Verfügung wird durch Kabinettsverordnung wie folgt festgelegt:
(i) Eintragung von Agrochemikalien auf Basis der Bestimmung des Gesetzes über die Regelung von Agrochemikalien; und
(ii) Zulassung und Registrierung pharmazeutischer Produkte, pharmazeutischer Produkte für in vitro Diagnosen, Produkte für Regenerationsmedizin u. dgl. auf Basis der Bestimmung des Gesetzes über pharmazeutische Produkte und medizinische Geräte